Coronavirus Covid-19 Impfung
Mittlerweile sind mehrere Impfstoffe gegen COVID-19 auf dem Markt. Laut WHO befinden sich noch mehr als 40 Impfstoffe in der Entwicklung, die auf verschiedenen Konzepten beruhen (z. B. DNA, mRNA, Protein Subunit oder Vektor-Impfstoffe).
Impfstoffe auf Genbasis: Diese Impfstoffe enthalten Genmaterial in Form von DNA oder mRNA. Man versucht mit geeigneten Trägersubstanzen, die DNA und RNA in körpereigene Zellen einzuschleusen, um dann die Körperzellen dazu bewegen, bestimmte Proteine des Virus zu produzieren. Diese Proteine sollen das Abwehrsystem stimulieren und Antikörper produzieren, Bisher sind solche Impfstoffe noch nicht auf dem Markt und daher mit unkalkulierbaren Risiken verbunden.
Folgende Unternehmen entwickeln genbasierte Impfstoffe: Inovio, Moderna, CureVac, BioNTech, Arcturus, LineaRx/Takis, Anges, Translate Bio/Sanofi; Konsortium OpenCorona
Lebendimpfstoffe mit Vektorviren: Hierbei werden andere Viren als Trägerviren verwendet („Modifizierte Vaccinia-Virus Ankara“ (MVA), Adenovirus Serotyp 26 oder Masernviren) Diese Viren werden verändert, indem man an diese SARS-CoV-2-Proteine koppelt, gegen die die dann das Abwehrsystem einen Immunschutz aufbauen soll. Dieses Verfahren wurde bereits bei Ebola Impfstoff verwendet, der jedoch noch nicht zugelasen ist.
Folgende Unternehmen entwickeln Vektorvirenimpfstoffe: Janssen, DZIF und University of Oxford
Todimpfstoffe mit Virusproteinen: Dieses Verfahren wird bei heute bei den meisten Impfstoffen angewandt. Hierbei koppelt man Virusproteine an bestimmte Trägersubstanzen (Aluminium oder andere Wirkungsverstärker) und will damit die Produktion von Antikörpern bewirken
Unternehmen, die Todimpfstoffe mit Sars-CoV2 Proteinen entwickeln: Novavax, Greffex und University of Queensland
Impfstoffe
Folgende Impfstoffe befinden sich mittlerweile auf dem europäischen Markt und haben eine Zulassung.
Eine Dosis (0,5 ml) enthält 100 Mikrogramm Messenger-RNA (mRNA) (eingebettet in SM-102-Lipid- Nanopartikel).
Einzelsträngige mit 5’-gekappte Boten-RNA (messenger RNA, mRNA), die mit Hilfe einer zellfreien In-vitro-Transkription aus den entsprechenden DNA-Vorlagen hergestellt wird, den Code für das virale Spike(S)-Protein von SARS-CoV-2 kodiert und in Lipid-Nanopartikel eingebettet ist.
Lipid SM-102
Cholesterin
1,2-Distearoyl-sn-Glycero-3-Phosphocholin (DSPC) 1,2-Dimyristoyl-rac-Glycero-3-Methoxypolyethylenglykol-2000 (DMG-PEG2000) Trometamol
Trometamolhydrochlorid
Essigsäure
Natriumacetat-Trihydrat
Sucrose
Wasser für Injektionszwecke
1 Dosis (0,3 ml) enthält 30 Mikrogramm COVID-19-mRNA-Impfstoff (eingebettet in Lipid- Nanopartikel).
Einzelsträngige, 5'-gekappte Boten-RNA (mRNA), die unter Verwendung einer zellfreien in-vitro- Transkription aus den entsprechenden DNA-Vorlagen hergestellt wird und das virale Spike (S)- Protein von SARS-CoV-2 kodiert.
((4-Hydroxybutyl)azandiyl)bis(hexan-6,1-diyl)bis(2-hexyldecanoat) (ALC-0315) 2-[(Polyethylenglykol)-2000]-N,N-ditetradecylacetamid (ALC-0159) Colfoscerilstearat (DSPC)
Cholesterol
Kaliumchlorid
Kaliumdihydrogenphosphat
Natriumchlorid
Natriummonohydrogenphosphat 2H2O
Saccharose
Wasser für Injektionszwecke
AstraZeneca COVID-19-Impfstoff (ChAdOx1-S [rekombinant])
https://www.ema.europa.eu/documents/product-information/covid-19-vaccine-astrazeneca-epar-product-information_de.pdf
Eine Dosis (0,5 ml) enthält:
Schimpansen-Adenovirus, der das SARS-CoV-2-Spike-Glykoprotein (ChAdOx1-S)* kodiert, nicht weniger als 2,5 x 108 infektiöse Einheiten (IE)
*Hergestellt in genetisch veränderten, humanen embryonalen Nieren 293-Zellen (HEK, human embryonic kidney) und durch rekombinante DNA-Technologie.
Dieses Produkt enthält genetisch veränderte Organismen (GVOs).
Liste der sonstigen Bestandteile:
Histidin
Histidinhydrochlorid-Monohydrat
Magnesiumchlorid-Hexahydrat
Polysorbat 80 (E 433)
Ethanol
Sucrose
Natriumchlorid
Natriumedetat (Ph.Eur.)
Wasser für Injektionszwecke
Huname Embryonale Nieren 293 Zellen stammen aus abgetriebenen Embryonen/Föten
Der Astra Zeneca Impfstoff ist im vergleich zu den beiden mRNA Impfstoffen, ein sogenanter Vektorimpfstoff. Dabei wurden in einen Adenovirus eines Schimpansen die DNA des Spike Proteins des Corona Virus integriert. D.h. es handelt sich dabei um einen genmanipulierten Impfstoff. Die DNA des Adenovirus mit der DNA des Corona Virus kann in die menschliche DNA eingebaut werden. Dies geschieht zwar selten: 1 von 1 Mio. Viren DNA wird eingebaut, aber da der Impfstoff je nach Dosierung 25-50 Milliarden Viren enthält, können rein rechnerisch 25-50.000 Zellen betroffen sein.
Nuvaxovid Injektionsdispersion
COVID-19-Impfstoff (rekombinant, adjuvantiert)
https://www.ema.europa.eu/en/documents/product-information/nuvaxovid-epar-product-information_de.pdf
Es handelt sich um eine Mehrdosen-Durchstechflasche, die 10 Dosen zu je 0,5 ml enthält.
Eine Dosis (0,5 ml) enthält 5 Mikrogramm des Spike-Proteins* von SARS-CoV-2 und ist mit Matrix-M adjuvantiert.
Das Adjuvans Matrix-M enthält pro 0,5-ml-Dosis: Fraktion-A (42,5 Mikrogramm) und Fraktion-C (7,5 Mikrogramm) von Quillaja-saponaria-Molina-Extrakt.
* hergestellt mittels rekombinanter DNA-Technologie unter Verwendung eines Baculovirus-Expressi-onssystems in einer Insektenzelllinie aus Sf9-Zellen der Spezies Spodoptera frugiperda.
Liste der sonstigen Bestandteile
Dinatriumhydrogenphosphat 7 H2O
Natriumdihydrogenphosphat 1 H2O
Natriumchlorid
Polysorbat 80
Natriumhydroxid (zur Einstellung des pH-Werts)
Salzsäure (zur Einstellung des pH-Werts)
Wasser für Injektionszwecke
Adjuvans (Matrix-M)
Cholesterol
Phosphatidylcholin (einschließlich all-rac-α-Tocopherol)
Kaliumdihydrogenphosphat
Kaliumchlorid
Dinatriumhydrogenphosphat 2 H2O
Natriumchlorid
Wasser für Injektionszwecke
Nebenwirkungen, Impfkomplikationen und Impfschäden der Covid-19 Impfung
COVID-19 Vaccine Moderna
Die Fachinformation listet folgende Nebenwirkungen auf:
Die Sicherheit von COVID-19 Vaccine Moderna wurde in einer laufenden randomisierten, placebokontrollierten, beobachterverblindeten klinischen Studie der Phase III in den Vereinigten Staaten bei 30.351 Teilnehmern ab 18 Jahren, die mindestens eine Dosis COVID-19 Vaccine Moderna
(n = 15.185) oder Placebo (n = 15.166) erhielten, durchgeführt (NCT04470427). Zum Zeitpunkt der Impfung betrug das mittlere Alter der Population 52 Jahre (Bereich 18–95); 22.831 Teilnehmer (75,2 %) waren 18 bis 64 Jahre alt und 7.520 Teilnehmer (24,8 %) waren 65 Jahre alt oder älter.
Die am häufigsten berichteten Nebenwirkungen waren Schmerzen an der Injektionsstelle (92 %), Müdigkeit (70 %), Kopfschmerzen (64,7 %), Myalgie (61,5 %), Arthralgie (46,4 %), Schüttelfrost
(45,4 %), Übelkeit/Erbrechen (23 %), Schwellung/Schmerzempfindlichkeit der axillären Lymphknoten (19,8 %), Fieber (15,5 %), Schwellung an der Injektionsstelle (14,7 %) und Rötung (10 %). Die Nebenwirkungen waren für gewöhnlich leicht oder mittelgradig ausgeprägt und bildeten sich innerhalb von wenigen Tagen nach der Impfung zurück. Bei älteren Probanden traten reaktogene Ereignisse etwas weniger häufig auf.
Insgesamt wiesen jüngere Altersgruppen eine höhere Inzidenz bei einigen Nebenwirkungen auf: Die Inzidenz von Schwellung/Schmerzempfindlichkeit der axillären Lymphknoten, Müdigkeit, Kopfschmerzen, Myalgie, Arthralgie, Schüttelfrost, Übelkeit/Erbrechen und Fieber war bei Erwachsenen im Alter von 18 bis < 65 Jahren höher als bei Erwachsenen im Alter von > 65 Jahren.
Lokale und systemische Nebenwirkungen wurden nach Dosis 2 häufiger berichtet als nach Dosis 1.
|
|
|
|
Erkrankungen des Blutes und des Lymphsystems
|
|
|
Erkrankungen des Immunsystems
|
|
Anaphylaxie Überempfindlichkeit
|
Erkrankungen des Nervensystems
|
|
|
|
|
Akute periphere Fazialisparese**
|
Erkrankungen des Gastrointestinaltrakts
|
|
|
Erkrankungen der Haut und des Unterhautzellgewebes
|
|
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
|
|
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
|
|
Schmerzen an der Injektionsstelle Müdigkeit
Schüttelfrost
Fieber**
Schwellung an der Injektionsstelle
|
|
|
Erythem an der Injektionsstelle Urtikaria an der Injektionsstelle Hautausschlag an der Injektionsstelle
|
|
|
Juckreiz an der Injektionsstelle
|
|
|
|
Comirnaty (Biontech, Pfizer)
Die Fachinformation listet folgende Nebenwirkungen auf:
Die Sicherheit von Comirnaty wurde bei Teilnehmern ab 16 Jahren in 2 klinischen Studien untersucht, in denen 21.744 Teilnehmer mindestens eine Dosis von Comirnaty erhalten haben.
In Studie 2 erhielten insgesamt 21.720 Teilnehmer ab 16 Jahren mindestens 1 Dosis Comirnaty und insgesamt 21.728 Teilnehmer ab 16 Jahren erhielten Placebo (darunter 138 und 145 Jugendliche im Alter von 16 und 17 Jahren in der Impfstoff- bzw. Placebogruppe). Insgesamt 20.519 Teilnehmer ab 16 Jahren erhielten 2 Dosen Comirnaty.
Zum Zeitpunkt der Analyse von Studie 2 wurden insgesamt 19.067 (9.531 Comirnaty und 9.536 Placebo) Teilnehmer ab 16 Jahren mindestens 2 Monate nach der zweiten Comirnaty-Dosis auf Verträglichkeit untersucht. Darunter waren insgesamt 10.727 (5.350 Comirnaty und 5.377 Placebo) Teilnehmer im Alter von 16 bis 55 Jahren und insgesamt 8.340 (4.181 Comirnaty und 4.159 Placebo) Teilnehmer ab 56 Jahren.
Die häufigsten Nebenwirkungen bei Teilnehmern ab 16 Jahren waren Schmerzen an der Injektionsstelle (> 80 %), Müdigkeit (> 60 %), Kopfschmerzen (> 50 %), Myalgie und Schüttelfrost (> 30 %), Arthralgie (> 20) %), Fieber und Schwellung an der Injektionsstelle (> 10 %), die normalerweise von leichter oder mäßiger Intensität waren und innerhalb weniger Tage nach der Impfung abklangen. Eine etwas geringere Häufigkeit von Reaktogenitätsereignissen war mit einem höheren Alter verbunden.
Tabelle 1: Nebenwirkungen von Comirnaty aus klinischen Studien
|
|
|
häufig (≥ 1/100 bis < 1/10)
|
Gelegentlich (≥ 1/1.000 bis < 1/100)
|
Selten (≥ 1/10.000 bis
< 1/10.000)
|
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
|
Erkrankungen des Blutes und des Lymphsystems
|
|
|
|
|
|
Erkrankungen des Immunsystems
|
|
|
|
|
Anaphylaxie; Überempfindlichkeit
|
Psychiatrische Erkrankungen
|
|
|
|
|
|
| Erkrankungen des Nervensystems |
Kopfschmerzen |
|
|
akute periphere Fazialis- parese† |
|
| Erkrankungen des Gastrointestinaltrakts |
|
Übelkeit |
|
|
|
| Skelettmuskula- tur-, Bindege- webs- und Knochenerkrankungen |
Arthralgie; Myalgie |
|
|
Schmerzen in den Extremitäten |
|
Allgemeine Erkrankungen und Beschwerden am
Verabreichungsort |
Schmerzen an der Injektions- stelle; Müdigkeit; Schüttel- frost; Fieber*; Schwellung an der Injektions- stelle |
Rötung an der Injektionsstelle |
|
Unwohlsein; Juckreiz an der Injektions- stelle |
|
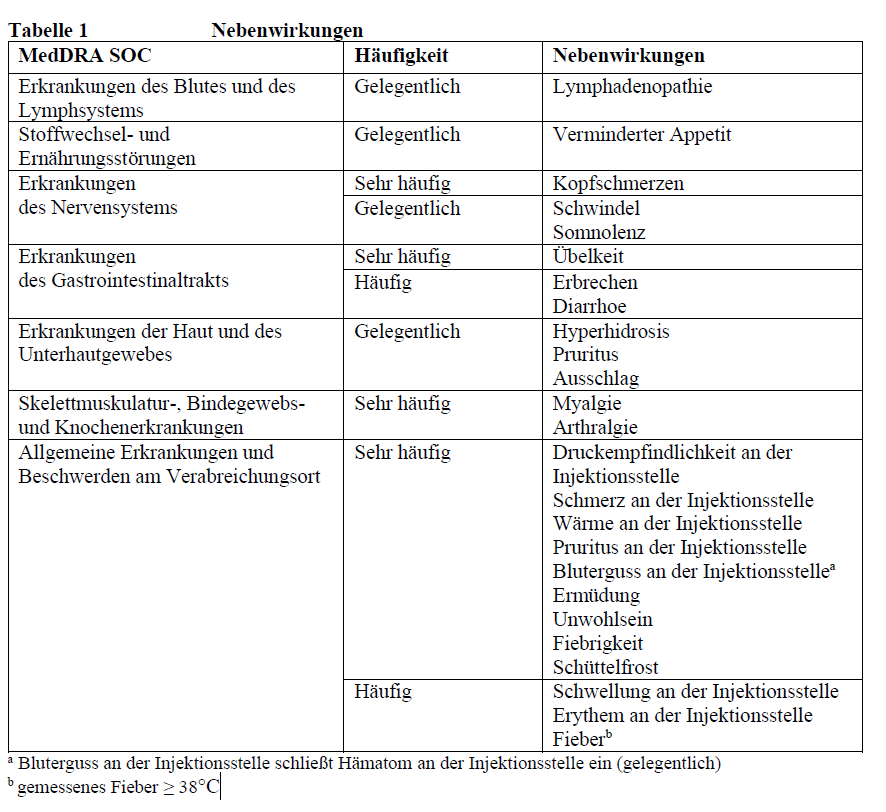
AstraZeneca COVID-19-Impfstoff (ChAdOx1-S [rekombinant])
Die Fachinformation listet folgende Nebenwirkungen auf:
Zusammenfassung des Sicherheitsprofils
Die Gesamtsicherheit von COVID-19 Vaccine AstraZeneca basiert auf einer Interimsanalyse gepoolter Daten aus vier klinischen Studien, die im Vereinigten Königreich, in Brasilien und in Südafrika durchgeführt wurden. Zum Zeitpunkt der Analyse waren 23 745 Teilnehmer ≥ 18 Jahre randomisiert und erhielten entweder COVID-19 Vaccine AstraZeneca oder eine Kontrollsubstanz. Von diesen erhielten 12 021 mindestens eine Dosis COVID-19 Vaccine AstraZeneca und 8 266 erhielten zwei Dosen. Die mediane Nachverfolgungsdauer betrug 62 Tage nach Dosis 2. Die am häufigsten berichteten Nebenwirkungen waren Druckempfindlichkeit an der Injektionsstelle (63,7 %), Schmerzen an der Injektionsstelle (54,2 %), Kopfschmerzen (52,6 %), Ermüdung (53,1 %), Myalgie (44,0 %), Unwohlsein (44,2 %), Pyrexie (einschließlich Fiebrigkeit (33,6 %) und Fieber > 38°C (7,9 %)), Schüttelfrost (31,9 %), Arthralgie (26,4 %) und Übelkeit (21,9 %). Die Mehrzahl der Nebenwirkungen war von leichtem bis moderatem Schweregrad und ging üblicherweise binnen weniger Tage nach der Impfung wieder vollständig zurück. Im Vergleich zur ersten Dosis waren die nach der zweiten Dosis berichteten Nebenwirkungen milder und wurden weniger häufig berichtet.
Bei älteren Erwachsenen (≥ 65 Jahre) war die Reaktogenität generell milder und wurde weniger häufig berichtet.
Das Sicherheitsprofil war über alle Teilnehmer hinweg, mit oder ohne Beleg einer vorherigen SARS-CoV-2-Infektion bei Studieneinschluss, einheitlich; die Anzahl an seropositiven Teilnehmern bei Studieneinschluss betrug 718 (3,0 %).
Tabellarische Auflistung der Nebenwirkungen
Die Nebenwirkungen sind nach MedDRA-Systemorganklassen (SOC, system organ class) aufgeführt.
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt: sehr
häufig (> 1/10), häufig (> 1/100 bis < 1/10), gelegentlich (> 1/1 000 bis < 1/100), selten (> 1/10 000
bis < 1/1 000), sehr selten (< 1/10 000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren
Daten nicht abschätzbar); innerhalb jeder SOC sind die bevorzugten Begriffe nach abnehmender
Häufigkeit und dann nach abnehmendem Schweregrad dargestellt.
Grundsätzliche Probleme mit den Covid-19 Impfstoffen:
-
Die klinischen Phasen (mit Menschen) wurden extrem verkürzt
-
Die obligatorischen Phasen wurden aufgrund des zeitlichen und politischen Drucks zusammengeschoben (teleskopiert) sowie übereinandergelegt (parallelisiert)
-
Die Beobachtungsräume wurden verkleinert, so dass Nebenwirkungen nur rudimentär erkannt werden konnten (innerhalb von zwei Monaten statt 7-10 Jahren
-
Die Testpersonen waren entweder nur an jüngeren Erwachsenen getestet
-
Die Testpersonen waren max. 55 Jahre alt oder/und machten nur wenige Prozente aller Getesteten aus
-
Das eigentliche Ziel «sterile Immunität» wurde gar nicht getestet
-
Es lässt sich nicht sagen, ob die Geimpften den Virus nicht doch weitergeben können
-
Die derzeitige Datenlage spricht für eine Weitergabe des Virus
-
Die Infektionskette lässt sich somit durch eine Impfung nicht durchbrechen
-
Die Wirksamkeit eines Impfstoffs wird auch anhand von Vergleichen ermittelt
-
Bei den COVID-19-Impfstoffen ist dies so nicht möglich
-
Bisher wurden noch kein einziger mRNA-Impfstoff weltweit zugelassen
-
Die Wirksamkeit eines Impfstoffs wird auch an Kohortenstudien ermittelt (geimpfte und nicht geimpfte Probanden)
-
So kann die Infektionsrate nach einer bestimmten Zeit bestimmt werden und die Entwicklung festgestellt werden
-
Diese Studien benötigen jedoch viel Zeit, die vorliegend nicht vorhanden ist aufgrund des Drucks
Inzwischen sind die Daten eindeutig, dass für über 80% der Covid-19-Patienten diese Erkrankung ohne oder nur mit milden Symptomen verläuft. Also für 80% stellt diese Erkrankung kein Problem dar. 15. Okt.2020: Insgesamt errechnete Prof. Ioannidis einen Median der Infektionssterblichkeit über 51 Standorte hinweg von 0,27 Prozent, korrigiert 0,23 Prozent. In Regionen mit weniger als 118 Todesfällen pro eine Million Menschen betrug die Rate lediglich 0,09 Prozent. Betrachtet man nur Bevölkerungsgruppen mit Menschen unter 70 Jahren, betrug die durchschnittliche Rate sogar nur 0,05 Prozent. (John P.A. Ioannidis ist Professor für Medizin, Epidemiologie und öffentliche Gesundheit, für biomedizinische Wissenschaft und Statistik an der Stanford University sowie Co-Direktor des Stanford Meta-Research Innovation Center - er zählt seit Jahren zu den in der wissenschaftlichen Literatur am häufigsten zitierten medizinischen Fachleuten.) https://www.n-tv.de/wissen/Covid-19-weniger-toedlich-als-vermutet-article22104272.html
«Wenn man von einer Letalität bei COVID-19 von im Median ca. 0,05% bei < 70- Jährigen weltweit ausgeht, wird es sehr schwer, in dieser Gruppe überhaupt einen Nutzen eines Impfstoffs nachzuweisen.»(Genetiker und Virologe William Haseltine; emer. professor an der Harvard Medical School and Harvard School of Public Health, Pionierarbeit an AIDS/HIV-Forschung) https://www.scientificamerican.com/article/the-risks-of-rushing-a-covid-19-vaccine/. Die Wahrscheinlichkeit, einen Impfschaden zu erleiden, liegt hier sehr viel höher, als der etwaige Nutzen in diser Gruppe.
„Keine der derzeit laufenden Studien zielt darauf ab, eine Verringerung schwerwiegender Ergebnisse wie Krankenhauseinweisungen, Intensivpflege oder Todesfälle zu erkennen. ... Krankenhauseinweisungen und Todesfälle von Covid-19 sind einfach zu selten in der Bevölkerungsgruppe, die auf einen wirksamen Impfstoff untersucht wird, um statistisch signifikante Unterschiede in einer Studie mit 30 000 Menschen aufzuzeigen.“ (Peter Doshi, “Will covid-19 vaccines save lives? Current trials aren’t designed to tell us”, British Medical Journal, 21.10.2020). (Peter Doshi ist Mitherausgeber von The BMJ und Mitglied des News & Views Teams. Er ist Assistenzprofessor für pharmazeutische Versorgungsforschung an der University of Maryland School of Pharmacy. Sein Forschungsschwerpunkt liegt auf der Bewertung von Arzneimittelsicherheit und -wirksamkeit im Kontext von Regulierung, evidenzbasierter Medizin und Debatten über den Zugang zu Daten.)
Es ist auch wichtig zu verstehen, dass sich die von BioNTech und Pfizer berichteten „zu 90 Prozent wirksam“ auf die Reduktion von Infektionen, nicht von schweren Erkrankungen oder gar Todesfällen bezieht. Es ist bekannt, dass mRNA-Corona-Impfstoffe zu schwereren Verläufen von Covid führen können, als dass ohne Impfung zu erwarten wäre. Seit fast vier Monaten (Okt. 2020) ist den Behörden diese Tatsache bekannt. Konkret bedeutet das: Die IMPFUNG BEWIRKT U.U. GENAU DAS GEGENTEIL DESSEN, WAS SIE SOLLTE UND WAS KOMMUNIZIERT WIRD. Das Phänomen, dass manche Patienten erst auf die Impfung hin Covid erkrankten, wird so evident. Und: Sollte sich eine Corona-positive Person impfen, die dies womöglich nicht bemerkte, so könnte erst durch die Impfung zu einem Covid-Ausbruch mit schwerem Verlauf kommen. Die Impfung würde dies demnach nicht verhindern, sondern erst initiieren. In einer im International Journal of Clinical Practice Ende Oktober veröffentlichten Studie wird diese Gefahr ausdrücklich untersucht und bestätigt; es handelt sich nicht um eine theoretische Gefahr, sondern eine wissenschaftlich, handfest geprüfte. https://onlinelibrary.wiley.com/doi/10.1111/ijcp.13795
Nuvaxovid Injektionsdispersion
COVID-19-Impfstoff (rekombinant, adjuvantiert)
Die Fachinformation listet folgende Nebenwirkungen auf:
Zusammenfassung des Sicherheitsprofils
Die Sicherheit von Nuvaxovid wurde anhand einer Zwischenanalyse von gepoolten Daten aus 5 klinischen Studien, die in Australien, Südafrika, im Vereinigten Königreich, in den USA und Mexiko laufen, beurteilt. Zum Zeitpunkt der Analyse hatten insgesamt 49.950 Teilnehmer ab 18 Jahren mindestens eine Dosis Nuvaxovid (n = 30.058) oder Placebo (n = 19.892) erhalten. Zum Zeitpunkt der Impfung lag das mediane Alter bei 48 Jahren (Bereich 18 bis 95 Jahre). Die mediane Dauer der Nachbeobachtung betrug 70 Tage nach der 2. Dosis, wobei 32.993 (66 %) Teilnehmer eine Nachbeoachtungszeit von mehr als 2 Monaten nach der 2. Dosis erreicht hatten.
In den gepoolten Reaktogenitätsdaten, die Teilnehmer ab 18 Jahren berücksichtigen, die an den beiden Phase-III-Studien teilnahmen und mindestens eine Dosis Nuvaxovid (n = 19.898) oder Placebo (n = 10.454) erhielten, waren die häufigsten Nebenwirkungen Druckempfindlichkeit an der Injektionsstelle (75 %), Schmerzen an der Injektionsstelle (62 %), Ermüdung (53 %), Myalgie (51 %), Kopfschmerzen (50 %), Unwohlsein (41 %), Arthralgie (24 %) und Übelkeit oder Erbrechen (15 %). Die Nebenwirkungen waren in der Regel leicht bis mittelschwer mit einer medianen Dauer von nicht mehr als 2 Tagen bei lokalen Ereignissen und nicht mehr als 1 Tag bei systemischen Ereignissen nach der Impfung.
Insgesamt traten Nebenwirkungen in jüngeren Altersgruppen häufiger auf: die Häufigkeit von Druckempfindlichkeit an der Injektionsstelle, Schmerzen an der Injektionsstelle, Ermüdung, Myalgie, Kopfschmerzen, Unwohlsein, Arthralgie und Übelkeit oder Erbrechen war bei Erwachsenen im Alter von 18 bis unter 65 Jahren höher als bei Personen im Alter ab 65 Jahren.
Lokale und systemische Nebenwirkungen wurden nach der 2. Dosis häufiger berichtet als nach der 1. Dosis.
Zugelassene inaktivierte saisonale Grippeimpfstoffe wurden 431 Teilnehmern einer explorativen Substudie der Phase III (2019nCoV-302) am gleichen Tag wie die 1. Dosis Nuvaxovid (n = 217) oder Placebo (n = 214) in den Deltamuskel des anderen Oberarms verabreicht. Die Häufigkeit lokaler und systemischer Nebenwirkungen war in der Population der Influenza-Substudie nach der 1. Dosis sowohl bei Nuvaxovid als auch bei Placebo höher als in der Population der Hauptstudie.
|
Tabelle 1: Nebenwirkungen aus klinischen Studien mit Nuvaxovid Systemorganklasse
|
Sehr häufig
(≥ 1/10)
|
Häufig
(≥ 1/100,
< 1/10)
|
Gelegentlich (≥ 1/1.000,
< 1/100)
|
|
Erkrankungen des
Blutes und des Lymphsystems
|
|
|
Lymphadenopathie
|
|
Erkrankungen des Nervensystems
|
Kopfschmerzen
|
|
|
|
Gefäßerkrankungen
|
|
|
Hypertonie
|
|
Erkrankungen des Gastrointestinaltrakts
|
Übelkeit oder Erbrechena
|
|
|
|
Erkrankungen der
Haut und des Unter- hautgewebes
|
|
|
Ausschlag
Erythem
Pruritus
Urtikaria
|
|
Skelettmuskulatur-,
Bindegewebs- und Knochenerkrankun-
gen
|
Myalgiea
Arthralgiea
|
|
|
|
Allgemeine Erkran-kungen und Beschwerden am Ver-abreichungsort
|
Druckempfindlich-keit an der Injekti-onsstellea
Schmerzen an der Injektionsstellea
Ermüdunga
Unwohlseina, b
|
Rötung an der Injek-tionsstellea, c
Schwellung an der Injektionsstellea
Fiebera
Schüttelfrost
Schmerzen in einer Extremität
|
Jucken an der Injektions-stelle
|
a Eine höhere Häufigkeit dieser Ereignisse wurde nach der zweiten Dosis beobachtet.
b Dieser Begriff umfasste auch Ereignisse, die als grippeähnliche Erkrankung gemeldet wurden.
c Dieser Begriff umfasst sowohl Rötung an der Injektionsstelle als auch Erythem an der Injektionsstelle (häufig).
Ein interessanter Artikel von Dr. Wolfgang Wodarg:
Thrombosen, Herzinfarkte und Hirnblutungen sind nach allen Impfstoffen möglich
Ein Artikel von Dr. Wolfgang Wodarg
Coronaviren und ihre Spikes kommen bei unkomplizierter Infektion nicht ins Blut. Die Immunbarrieren in den oberen Atemwegen verhindern das bei allen leichten Atemwegsinfektionen nicht nur für Coronaviren*.
Bei der Injektion von gentechnischen “Impfstoffen” in den Oberarmmuskel wird das jedoch umgangen. Es gibt dann drei mögliche Risiken der Impfungen, die ähnliche schwerwiegende Folgen haben können**:
1. Nach intramuskulärer Injektion muss damit gerechnet werden, dass die genbasierten Impfstoffe in die Blutbahn gelangen können und sich dann im Körper verbreiten [1; 2]
In solchen Fällen muss sodann damit gerechnet werden, dass die Impfstoffe im Blutkreislauf verteilt und von Endothelzellen aufgenommen werden. Das sind die Zellen, mit denen Blutgefäßwände ausgekleidet sind. Es ist anzunehmen, dass solche Aufnahme in Endothelzellen insbesondere an Stellen mit langsamem Blutfluss, also in kleinen Gefäßen und Kapillaren, geschieht.
Wenn das geschieht, werden die genetischen Informationen der Impfstoffe (z.B. mRNA) jene Endothelzellen veranlassen, Teile von Spike-Proteinen zu produzieren und an ihren Oberflächen den vorbeifließenden Blutzellen zu präsentieren.
Viele gesunde Personen haben CD8-Lymphozyten, die im Blut patrouillieren und solche Corona-Spike-Peptide erkennen, was auf eine frühere COVID-Infektion, aber auch auf Kreuzreaktionen mit anderen Coronavirus-Typen zurückzuführen sein kann [3; 4] [5].
Wir müssen davon ausgehen, dass diese CD8-Lymphozyten bei Kontakt einen Angriff auf die entsprechenden Zellen starten. Dadurch kann es an unzähligen Stellen im Körper zu Gefäßwandschädigungen mit anschließender Auslösung der Blutgerinnung durch Aktivierung der Blutplättchen (Thrombozyten) kommen. Das geschieht also wenn der Impfstoff selbst ins Blut gelangt.
Zwei weitere Risiken entstehen, wenn nicht der Impfstoff mit seinen genetischen Informationen, sondern die von unserem Körper durch ihn induzierten und in useren Zellen selbst hergestellten Spike-Proteine oder Teile davon ins Blut abgegeben werden.
2. Wenn solche gentechnisch in unseren Zellen erzeugten SARS-CoV-2-Spike-Proteine ins Blut gelangen, verbinden sie sich direkt mit den ACE2-Rezeptoren der Thrombozyten, was auch zu Blutverklumpungen und Thrombosen führt [6][7]. Das ist auch bei ganzen Coronaviren, die in seltenen Fällen ins Blut gelangen, beobachtet worden. Bei geimpften Personen wurde auch über so entstandene Thrombozytopenien berichtet [8][9][10].
3. Hinzu kommt die Fähigkeit der SARS-CoV-2-Spike-Proteine sehr stark Zellfusionen zu initiieren. Die dadurch entstehenden Riesenzellen können ebenfalls zu Gefäßverlegungen, Entzündungsreaktionen und Mikrothrombosen führen.(11)
Was kann bei allen drei Ursachen die Folge sein:
Bei Blutuntersuchungen kann man das am Abfall der Thrombozytenzahl und am Auftreten von D-Dimeren (Fibrinabbauprodukte) im Blut erkennen. Klinisch kann es zu unzähligen Schäden in Folge von Durchblutungsstörungen im ganzen Körper, einschließlich im Gehirn, Rückenmark und Herz kommen. Wegen eines solchen Verbrauchs von Gerinnungsfaktoren und Blutplättchen können auch Blutungen in verschiedenen Organen auftreten und z.B. im Gehirn tödliche Folgen haben.
Wichtig ist: Für alle genannten Möglichkeiten, die zu einer disseminierten intravasalen Gerinnung (DIC) führen können, fehlt bei allen drei Impfstoffen der Nachweis, dass diese vor ihrer Zulassung zur Anwendung am Menschen durch die EMA ausgeschlossen wurden.
Anmerkung der Redaktion: Das Paul-Ehrlich-Institut hat am 16. März 2021 nach dem Auftreten von sieben Hirnvenenthrombosen, einer extrem seltenen Krankheit, vier bis 16 Tage nach der Impfung zunächst die Anwendung des AstraZeneca-Impfstoffs ausgesetzt. Die EMA, der die europäische Aufsicht über die Impfstoffe obliegt, hat jedoch binnen 48 Stunden einen Zusammenhang mit der Impfung verneint.
*Die mit atypischen Virusinfektionen in die Kliniken eingelieferten Patienten haben zumeist auch Mehrfachinfektionen (12) , die aber gerade in Zeiten der Fixierung auf Covid-19 leider nur selten differentialdiagnostisch abgeklärt werden.
**Die ersten beiden dargestellten Fragen sind am 28.2.2020 auch von einer internationalen Wissenschaftlergruppe an die Europäische Arzneimittelzulassungsbehörde gestellt worden.
Referenzen:
[1] Hassett, K. J.; Benenato, K. E.; et al.(2019).Optimization of Lipid Nanoparticles for Intramuscular Administration of mRNA Vaccines, Molecular therapy. Nucleic acids 15 : 1-11.
[2] Chen, Y. Y.; Syed, A. M.; MacMillan, P.; Rocheleau, J. V. and Chan, W. C. W.(2020). Flow Rate Affects Nanoparticle Uptake into Endothelial Cells, Advanced materials 32 : 1906274.
[3] Grifoni, A. et al.(2020). Targets of T Cell Responses to SARS-CoV-2 Coronavirus in Humans with COVID-19 Disease and Unexposed Individuals, Cell 181 : 1489-1501.e15.
[4] Nelde, A.; Bilich et al. (2020). SARS-CoV-2-derived peptides define heterologous and COVID-19-induced T cell recognition, Nature immunology.
[5] Sekine, T. et al.(2020). Robust T Cell Immunity in Convalescent Individuals with Asymptomatic or Mild COVID-19, Cell 183 : 158-168.e14.
[6] Zhang, S.; Liu, Y.; Wang, et al. (2020). SARS-CoV-2 bindet Thrombozyten-ACE2, um die Thrombose in COVID-19 zu fördern, Journal of hematology & oncology 13 : 120.
[7] Lippi, G. et al. 2019 (COVID-19) infections: A meta-analysis, Clin. Chim. Acta 506 : 145-148.
[8] Grady, D. (2021). A Few Covid Vaccine Recipients Developed a Rare Blood Disorder, The New York Times, Feb. 8, 2021.
[9] Geoffrey D. Wool,: The Impact of COVID-19 Disease on Platelets and Coagulation, DOI: 10.1159/000512007
[10] Giannis D, Ziogas IA, Gianni P. Coagulation disorders in coronavirus infected patients: COVID-19, SARS-CoV-1, MERS-CoV and lessons from the past. J Clin Virol. 2020 Jun; 127: 104362.
[11] Theuerkauf et al., iScience 24, 102170, March 19, 2021[12]Nickbakhsh, Sema, (2019 ) Virus–virus interactions impact the population dynamics of influenza and the common cold, www.pnas.org/cgi/doi/10.1073/pnas.1911083116 [12]Virus–virus interactions impact the population dynamics of influenza and the common cold, Sema Nickbakhsh, et al. (2019)MRC-University of Glasgow, Centre for Virus Research
Auflistung von gemeldeten Nebenwirkungen/Todesfällen unmittelbar nach einer Impfung:
Grundsätzliche Probleme mit Coronavirus Impfstoffen
Coronaviren enthalten offensichtlich eine ganze Reihe von immunogenen Proteinen, die eine enge Verwandtschaft zu Schlüsselproteinen des Immunsystems haben (https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7142689/). Die Konfrontation des Immunsystems mit diesen adjuvatierten Proteinen in einem Impfstoff könnte zu einem sogenannten "pathologischen Priming" führen. Dies bedeutet eine massive Reaktion des Immunsystems bei Kontakt mit dem Wildvirus und möglicherweise Auslösung von Autoimmunpathologien.
Bereits frühere Tierversuche mit SARS-Impfstoffkandidaten in den Jahren 2003 führten nach gezielter Infektion mit den entsprechenden Wildviren zu einer TH2-Immunpathologie mit eosinophilen(bestimmte Abwehrzellen) Infiltraten in der Lunge (https://www.ncbi.nlm.nih.gov/pubmed/22536382 : "Caution in proceeding to application of a SARS-CoV vaccine in humans is indicated"). Dies war der Grund, warum man damals vor weiteren Versuchen mit Menschen warnte. Obwohl man diese Problematik kennt, werden jetzt im Rahmen der klinischen Prüfungen der neuen Coronavirus Impfstoffe, Tierversuche wegen "Zeitmangel" übersprungen und man geht direkt zu Menschenversuchen über.
Ein weiteres Problem sind Infektionsverstärkende Antikörper, diese werden bei einer Erstinfektion mit einigen Viren gebildet und bewirken erst bei einer Zweitinfektion mit dem gleichen oder einem ähnlichen Subtyp des Virus einen schwereren Krankheitsverlauf. Dieser Mechanismus schränkt die Möglichkeit einer Impfung bei einigen Viren erheblich ein, da die Erstinfektion in diesem Fall durch Gabe eines Impfstoffes zur aktiven Immunisierung imitiert wird und infektionsverstärkende Antikörper gebildet werden können.
Interessanter Artikel von Dr. Freia zur möglichen Genveränderung durch DNA/ mRNA Impfstoffe:
Möglichkeiten genomischer Veränderungen durch genetische Impfstoffe
1. DNA-Impfstoffe: sie verwenden meistens Plasmide, die ein oder mehrere Gene von
artfremden Proteinen enthalten. Diese Proteine sollen in den Zellen des Impflings zum Zwecke der
Immunisierung exprimiert werden. Für DNA-Impfstoffe wurden nadelfreie Injektionssysteme
entwickelt. Dabei wird die DNA an Goldpartikel gebunden und in den Muskel durch
eine Impfpistole injiziert. Am Injektionsort nehmen nicht nur Muskelzellen, sondern auch
Makrophagen und andere ortsständige, Antigen präsentierende Zellen das Impf-Plasmid auf und
tragen es in andere Bereiche des Körpers [1].
Plasmide sind ringförmige Doppelstrang-DNA-Moleküle, die sich innerhalb von Bakterien autonom
vermehren, während sie sich außerhalb eines Bakteriums im Zytoplasma einer eurkaryoten Zelle nicht
selbsttätig vermehren können. Daher, und weil diese extrachromosomalen Impf-Plasmide i.d.R. nach
einigen Wochen abgebaut werden, gelten sie als beherrschbar [2]. Entgegen dieser Überzeugung
möchte ich darstellen, warum die Vorstellung, man könnte die Verbreitung genetischer Information
von Impf-Plasmiden eingrenzen und beherrschen, Wunschdenken ist. Zunächst einmal können sich
die Impf-Plasmide unter Zuhilfenahme eines Prozesses, der als Transformation bekannt ist, eben doch
vermehren. Als Transformation bezeichnet man den Vorgang, bei dem Bakterien freie DNA-Stückchen
oder Plasmide in sich aufnehmen, und ihrem Genom hinzufügen. Diesen Vorgang kann man z.B. unter
[3] nachlesen. Nehmen Bakterien die Gene des DNA-Impfstoffes auf, können diese Gene fortan in den
Bakterien, von denen sie aufgenommen wurde, repliziert werden. Zellen fast aller Lebewesen, auch
die von uns Menschen, beherbergen im Innern zahlreiche, zum Teil obligate, intrazelluläre Bakterien
[4]. Wie andere Bakterien, besitzen auch sie die Fähigkeit zur Transformation. Daher sind
intrazelluläre Bakterien Kandidaten für die Aufnahme und Vermehrung von Impf-Plasmiden [5]. Bei
Zellzerfall oder durch aktive Ausschleusung verlassen intrazelluläre Bakterien ihre „Mutter“-Zelle, und
können nun z.B. über die Blutzirkulation Zellen anderer Körperbereiche erreichen und so ihre
genetische Information in weitere Zellen mitnehmen. Intrazelluläre Bakterien hätten also die
Fähigkeit, die Information der Impf-Plasmide, wenn sie diese einmal aufgenommen und integriert
haben, im Laufe der Zeit im gesamten Körper zu verteilen. Da Bakterien nicht nur DNA aufnehmen,
sondern auch ausschleusen [6], könnten die Gene der Impf-Plasmide (vermutlich in abgewandelter
oder mutierter Form) mit der Zeit überall im Körper wieder in das Zytoplasma der Zellen gelangen.
Auch wenn der Literatur im Moment nicht zu entnehmen ist, unter welchen Bedingungen
extrachromosomale DNA abgebaut, von Bakterien aufgenommen oder in das Genom eingebaut wird,
ist jedenfalls bekannt und sogar bei Wikipedia nachzulesen, dass Plasmid-DNA als zufälliges oder
seltenes lokales Ereignis in die DNA der Empfängerzelle eingebaut werden kann [7]. Sollte in der Zeit
nach einer DNA-Impfung allmählich überall im Körper Plasmid-DNA auftauchen, wird der Einbau dieser
Gene in das Genom des Geimpften immer wahrscheinlicher. An welcher Stelle im Erbgut und mit
welchen Konsequenzen dieses Ereignis auftritt kann keiner voraussagen Eine DNA-Übertragung im
Rahmen eines horizontalen oder lateraler Gentransfers (HGT od. LTG), der auch für Eukaryonten
existiert [8], lässt es ferner nicht ausgeschlossen erscheinen, dass Plasmid-DNA, die einmal in den
Körper eingebracht wurde, sich nicht nur in diesem, sondern auch in nicht geimpften Menschen
verteilt. Ein Einbau von Genen des Impf-Plasmids, oder von den mutierten Formen dieser Gene, in
Wirts-Genome scheint daher nur eine Frage der Zeit zu sein.
2. mRNA-Impfstoffe: sie schleusen auf verschiedene Weise mRNA in die Zellen des Impflings ein, wo sie
im Zytosol in die gewünschten Proteine umgeschrieben wird. Es wird behauptet, dass hier das Risiko
von DNA-Impfstoffen, nämlich ein Einbau von Impfstoffgenen in die DNA der Empfängerzelle,
ausgeschlossen wäre. Der Weg, auf dem die Information dieser mRNA dennoch in die Chromosomen
gelangen kann, möchte ich kurz skizzieren. Vorraussetzung für eine Insertion der mRNAGeninformation
in das Genom ist das Vorhandensein einer Reversen Transkriptase (RT), die dafür
sorgt, dass die mRNA in DNA umgeschrieben wird. RTs werden von verschiedenen Viren,
hauptsächlich von Retroviren, aber z.B. auch von Hepadnaviren (z.B. HBV) mitgebracht. Es gibt aber
auch humane, endogene Proteine, die RT-Aktivität zeigen. Damit kann der Schritt, der zum
Umschreiben der mRNA-Information in den Code der Doppelstrang-DNA (dsDNA) führt, prinzipiell in
jeder menschlichen Zelle ablaufen [9].
Schauen wir uns an, woher endogene RTs können stammen können. Ein möglicher Ursprung sind z.B.
sogenannte Transposons. Letztere sind „springende Gene“, die innerhalb des Genoms ihre Position
wechseln und sich ggf. dabei auch vermehren können. Rund 45% des menschlichen Genoms besteht
aus transposablen Elementen. Forschungsergebnisse von Eric Lander et al. (2007) zeigen, dass
Transposons eine durchaus wichtige Funktion haben, da sie als kreativer Faktor im Genom wichtige
genetische Innovationen rasch im Erbgut verbreiten können.
RNA-Transposons, auch als Retroelemente bezeichnet, springen, indem ihre DNA-Sequenz in einem
ersten Schritt in mRNA transkribiert wird. Anschließend werden entsprechend der Information dieser
mRNA die Transposon-Proteine synthetisiert. Um von dem RNA-Zustand wieder in den DNA-Zustand
zurück zu gelangen, von dem aus ein Transposon dann in das Genom zurückgelangen kann, codieren
viele Retroelemente für eine RT. [10], [11]. Es gibt also die prinzipielle Möglichkeit, dass eine
eingeimpfte mRNA, wenn sie langlebig ist (und das ist eine Voraussetzung für die Immunogenität der
Impfstoff-mRNA), in DNA umgeschrieben wird. Die Aktivierung von Transposons oder Retroelementen
erfolgt besonders bei zellulärem Stress (solcher könnte z.B. die Impfung selber sein), und führen in
humanen Oocyten, humanen Spermien und in neuronalen Progenitor Zellen zu Retrotransposition
[12].
DNA kann, wenn ihre Größe es erlaubt, per Diffusion vom Zytosol durch die Kernporen in den Zellkern
gelangen. Einmal im Kern angelangt, hat die Fremd-DNA alle Chancen der Welt, in die Wirts-DNA
aufgenommen und in das Genom integriert zu werden. Ein spannender Artikel des Ärzteblattes von
1997 beschreibt, wie fremde DNA über die Nahrung in unser Genom wandern kann [13]. Ob die
Integration von Fremd-DNA in das Genom abhängig vom Vorhandensein von Integrasen ist, die
ebenfalls von Transposons mitgebracht werden können, ist unklar, und beeinflusst nicht das Ergebnis
unserer Betrachtung.
Fazit: sowohl DNA-Impfstoffe wie RNA-Impfstoffe bergen die reale Gefahr einer Erbgut Kontamination.
Sowohl bei Plasmid-Impfstoffen, wie auch mRNA-Impfstoffen besteht durch horizontalen
Gentransfer auch eine Gefahr für andere Organismen.
1. I. Freudenau. Cole1-Plasmidproduktion in Escherichia Coli: Simulation und Experiment. Dissertation Universität
Bielefeld: 2014. S.5 ff
2. E.Buddecke. Molekulare Medizin: Eine systematische Einführung. Ecomed. 2002; S.163
3. https://de.wikipedia.org/wiki/Transformation_(Genetik)
4. J. Kreft. Neues aus der Trickkiste intrazellulärer Bakterien). Wissenschaft Journal Club. Springer-Verlag 2018; S.52
5. L. Czubatinski. Dissertation. Kaiserslautern: 2004; S.7 ff https://core.ac.uk/download/pdf/34226884.pdf,
6. G. Drews. Bakterien-ihre Entdeckung und Bedeutung für Natur und Mensch. Springer-Verlag 2.Auflage; Kap.10.9,
S.171
7. Z. Wang et.al. Detection of intergration of Plasmid DNA into host genomic DNA following intramuscular injection
and electroporation. Gene Therapy 11, 711-712 (2004)
8. A. Hartmann. Horizontaler Gentransfer-ein natürlicher Prozess. Helmholz-München. mensch+umwelt spezial,
17.Ausgabe, https://www.helmholtzmuenchen.
de/fileadmin/GSF/pdf/publikationen/mensch_und_umwelt_spezial/Heft17/59_64_Hartmann.pdf
9. J.-P. Mole`s et al. Cytosolic RNA:DNA Duplexes Generated by Endogenous Reverse Transcriptase Activity as
Autonomous Inducers of Skin Inflammation in Psoriasis. PLoS One. 2017; 12(1): e0169879. Published online
2017 Jan 10.1371/journal.pone.0169879
10. J. D. Boeke, V. D. Corces: Transcription and reverse transcription of retrotransposons In: Annu. Rev. Microbiol. 43,
1989, S. 403–434. doi:10.1146/annurev.mi.43.100189.002155
11. H. H. Kazazian: Mobile DNA transposition in somatic cells. In: BMC biology. Band 9, 2011, S. 62. doi:10.1186/1741-
7007-9-62. PMID 21958341. PMC 3182954.
12. J. Finley. Transposable elements, placental development, and oocyte activation: Cellular stress and AMPK links
jumping genes with the creation of human life. Med Hypotheses. 2018 Sep;118:44-54. doi:
10.1016/j.mehy.2018.05.015. Epub 2018 May 19.
13. W. Doerfler, R. Schubbert. Fremde DNA im Säugersystem: DNA aus Nahrung gelangt über die Darmschleimhaut in
den Organismus. Dtsch Ärztebl 1997; 94(51-52)
Tübingen, den 11. Mai 2020
Dr. med. Freia Hünig
Dipl.-Biologin
Fachärztin für Dermatologie
Zugelassene Impfstoffe
Für folgende Impfstoffe wurden bisher Zulassungen erteilt(https://de.wikipedia.org/wiki/SARS-CoV-2-Impfstoff)
- Details
-
Zuletzt aktualisiert: 28. Januar 2022






